Kit de diagnóstico para 25-hidroxivitamina D
1. USO PREVISTO
Este kit destina-se à detecção quantitativa in vitro de 25-hidroxi Vitamina D (25-OH Vitamina D) em amostras de soro/plasma humano para avaliar o nível de Vitamina D. O kit fornece apenas o resultado do teste de 25-hidroxi Vitamina D. O resultado obtido deve ser analisado em combinação com outras informações clínicas.Deve ser utilizado apenas por profissionais de saúde.
2. ESPECIFICAÇÃO DO PRODUTO
| Nº do modelo | 25-(OH)VD |
| Metodologia | Ensaio imunocromatográfico de fluorescência |
| Tipo de amostra | soro/plasma |
| Hora do resultado | 10-15 minutos |
| Armazenar | 2~30 ℃/36~86 ℉ |
| Validade | 24 meses |
| Certificado | ISO13485, CE, MHRA |


| COMPONENTES PRINCIPAIS DO KIT: *Dispositivo de teste *Uma solução *Tubo B *Instruções de uso | Embalagem: *25 teste/kit * Rotulagem de saco de folha de alumínio *embalar a vácuo |
3. MÉTODO DE TESTE
| 1 | Leia as instruções de uso e o manual de operação do teste completamente antes do teste e coloque o reagente na sala temperatura antes do teste.Não realize o teste sem restaurar o reagente à temperatura ambiente para evitar afetando a precisão dos resultados do teste. |
| 2 | Selecione o modo de teste padrão do analisador imunológico portátil WIZ-A101 |
| 3 | Abra a embalagem do saco de alumínio do reagente e retire o dispositivo de teste; |
| 4 | Insira horizontalmente o dispositivo de teste no slot do analisador imunológico; |
| 5 | Na página inicial da interface de operação do analisador imunológico, clique em “Padrão” para entrar na interface de teste; |
| 6 | Clique em “QC Scan” para digitalizar o código QR no lado interno do kit;insira os parâmetros relacionados ao kit no instrumento e selecione o tipo de amostra; Observação: Cada número de lote do kit deve ser digitalizado uma vez.Se o número do lote tiver sido digitalizado, pule esta etapa; |
| 7 | Verifique a consistência de “Nome do produto”, “Número do lote” etc. na interface do teste com as informações no rótulo do kit; |
| 8 | Depois que a consistência das informações for confirmada, comece a adicionar a amostra: Etapa 1: Colete lentamente 30 µL de amostra de soro/plasma de cada vez.Tenha cuidado para não desenhar bolhas. Etapa 2: Adicione a amostra coletada em uma solução (tubo de centrífuga transparente), extraia e sopre por 3-4 vezes (nota: o líquido na tampa da garrafa deve ser aspirado para dentro da garrafa); Etapa 3: Adicione toda a solução misturada na solução A (tubo de centrífuga transparente) no tubo B (tubo de centrífuga vermelho), mexa uniformemente (nota: certifique-se de que o marcador esteja imerso em líquido) e incube a 37 ℃ por 8 minutos; Etapa 4: Pipete 80µL do líquido da etapa 3 no orifício de amostra do dispositivo de teste.Evite formar bolhas durante a amostragem. |
| 9 | Após a adição completa da amostra, clique em “Timing” e o tempo restante do teste será exibido automaticamente na interface. |
| 10 | O analisador imunológico concluirá automaticamente o teste e a análise quando o tempo de teste for atingido. |
| 11 | Cálculo e exibição do resultado Após a conclusão do teste pelo analisador imunológico, o resultado do teste será exibido na interface de teste ou poderá ser visualizado em "Histórico" na página inicial da interface de operação. |
4. DESEMPENHO CLÍNICO
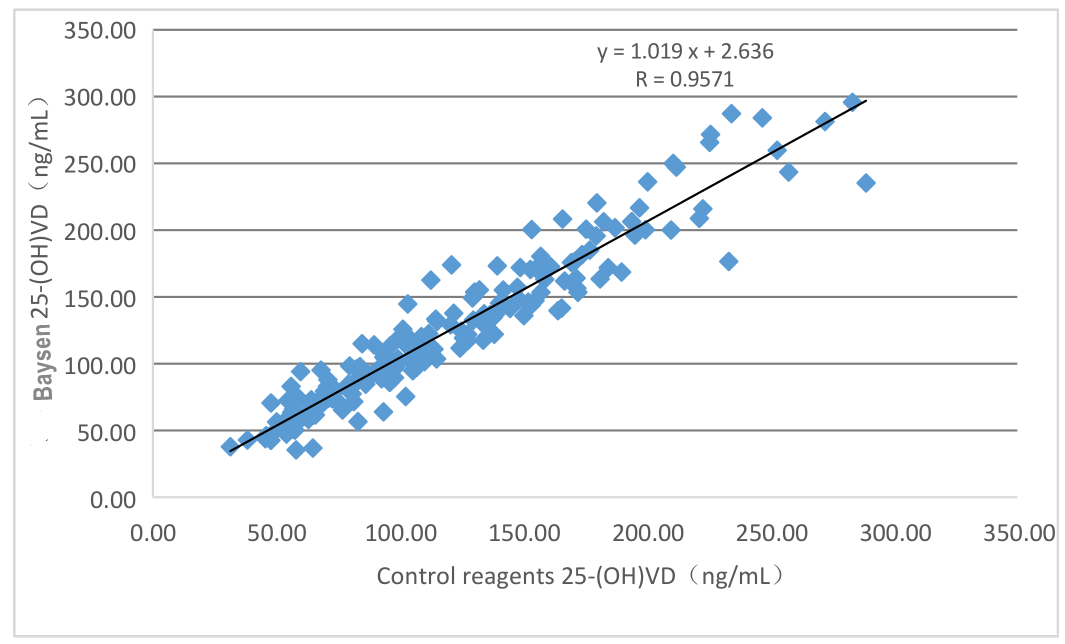
O desempenho da avaliação clínica do produto é avaliado por meio da coleta de 196 amostras clínicas.Os resultados são comparados usando o kit correspondente do kit de quimioluminescência comercializado como reagente de referência.Use regressão linear para investigar sua comparabilidade.Use a regressão linear para investigar sua comparabilidade.Os coeficientes de correlação dos dois testes são Y=1,019X-2,636 e R=0,9571, respectivamente.
5. CERTIFICADO
* Certificado do Sistema ISO
* Certificado CE
* Registro da UE
* Registro UCKA MHRA