Kit de diagnostic pour la 25-hydroxy vitamine D
1. UTILISATION CONFORME
Ce kit est destiné à la détection quantitative in vitro de la 25-hydroxy vitamine D (25-OH vitamine D) dans des échantillons de sérum/plasma humain afin d'évaluer le niveau de vitamine D. Le kit ne fournit que les résultats de test de la 25-hydroxy vitamine D. Le résultat obtenu doit être analysé en combinaison avec d'autres informations cliniques.Il ne doit être utilisé que par des professionnels de santé.
2. SPÉCIFICATION DU PRODUIT
| Numéro de modèle | 25-(OH)VD |
| Méthodologie | Dosage immunochromatographique de fluorescence |
| Échantillon type | sérum/plasma |
| Délai de résultat | 10-15 minutes |
| Stockage | 2 ~ 30 ℃/36 ~ 86 ℉ |
| Durée de conservation | 24mois |
| Certificat | ISO13485,CE,MHRA |


| COMPOSANTS PRINCIPAUX DU KIT : *Appareil d'essai *Une solution *Tuyau B *Mode d'emploi | Emballage: *25 tests/kit *Étiquetage des sacs en aluminium * film rétractable |
3. MÉTHODE D'ESSAI
| 1 | Lisez entièrement les instructions d'utilisation et le manuel d'utilisation avant le test et remettez le réactif dans la pièce température avant le test.Ne pas effectuer le test sans remettre le réactif à température ambiante pour éviter affectant la précision des résultats des tests. |
| 2 | Sélectionnez le mode de test standard de l'analyseur immunitaire portable WIZ-A101 |
| 3 | Ouvrez le sachet de réactif en aluminium et sortez le dispositif de test ; |
| 4 | Insérez horizontalement le dispositif de test dans la fente de l'analyseur immunitaire ; |
| 5 | Sur la page d'accueil de l'interface de fonctionnement de l'analyseur immunitaire, cliquez sur "Standard" pour accéder à l'interface de test ; |
| 6 | Cliquez sur "QC Scan" pour scanner le code QR à l'intérieur du kit ;entrez les paramètres liés au kit dans l'instrument et sélectionnez le type d'échantillon ; Remarque : Chaque numéro de lot du kit doit être scanné une seule fois.Si le numéro de lot a été scanné, ignorez cette étape ; |
| 7 | Vérifier la cohérence du « Nom du produit », du « Numéro de lot », etc. sur l'interface de test avec les informations sur l'étiquette du kit ; |
| 8 | Une fois la cohérence des informations confirmée, commencez à ajouter l'échantillon : étape 1 : prélevez lentement 30 µl d'échantillon de sérum/plasma à la fois.Faites attention de ne pas dessiner de bulles. Étape 2 : ajouter l'échantillon prélevé dans une solution (tube à centrifuger transparent), aspirer et souffler 3 à 4 fois (remarque : le liquide dans le bouchon de la bouteille doit être aspiré dans la bouteille) ; Étape 3 : Ajoutez toute la solution mélangée dans une solution (tube à centrifuger transparent) dans le tube B (tube à centrifuger rouge), remuez uniformément (remarque : assurez-vous que le tampon marqueur est immergé dans le liquide) et incubez à 37 ℃ pendant 8 minutes ; Étape 4 : Pipetez 80 µL du liquide de l'étape 3 dans le trou d'échantillon du dispositif de test.Évitez de dessiner des bulles pendant l'échantillonnage. |
| 9 | Après l'ajout complet de l'échantillon, cliquez sur « Timing » et le temps de test restant sera automatiquement affiché sur l'interface. |
| 10 | L'analyseur immunitaire terminera automatiquement le test et l'analyse lorsque l'heure du test sera atteinte. |
| 11 | Calcul et affichage des résultats Une fois le test effectué par l'analyseur immunitaire, le résultat du test s'affiche sur l'interface de test ou peut être visualisé via "Historique" sur la page d'accueil de l'interface de fonctionnement. |
4.PERFORMANCES CLINIQUES
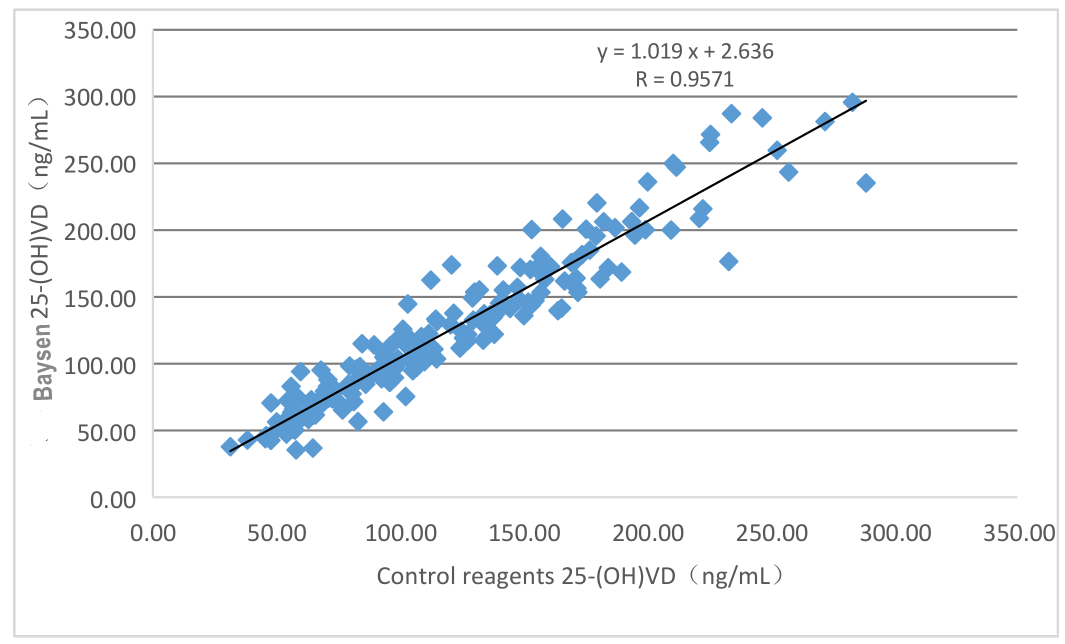
Les performances d'évaluation clinique du produit sont évaluées par la collecte de 196 échantillons cliniques.Les résultats sont comparés en utilisant le kit correspondant du kit de chimiluminescence commercialisé comme réactif de référence.Utilisez la régression linéaire pour étudier leur comparabilité.Utilisez la régression linéaire pour étudier leur comparabilité.Les coefficients de corrélation des deux tests sont respectivement Y=1,019X-2,636 et R=0,9571.
5. CERTIFICAT
* Certificat de système ISO
* Certificat CE
* Enregistrement UE
* Enregistrement UCKA MHRA