Kit de Diagnóstico para 25-hidroxi Vitamina D
1. USO PREVISTO
Este kit está diseñado para la detección cuantitativa in vitro de 25-hidroxi vitamina D (25-OH vitamina D) en muestras de suero/plasma humano para evaluar el nivel de vitamina D. El kit solo proporciona el resultado de la prueba de 25-hidroxi vitamina D. El resultado obtenido se analizará en combinación con otra información clínica.Solo debe ser utilizado por profesionales de la salud.
2. ESPECIFICACIONES DEL PRODUCTO
| N º de Modelo. | 25-(OH)VD |
| Metodología | Ensayo inmunocromatográfico de fluorescencia |
| Tipo de ejemplo | suero/plasma |
| Tiempo hasta el resultado | 10-15 minutos |
| Almacenamiento | 2~30 ℃/36~86 ℉ |
| Duración | 24 meses |
| Certificado | ISO13485 CE MHRA |


| COMPONENTES PRINCIPALES DEL KIT: *Dispositivo de prueba *Una solución *Tubo B *Instrucciones de uso | Embalaje: *25 pruebas/equipo *Etiquetado de bolsas de papel de aluminio *Envoltura retráctil |
3. MÉTODO DE PRUEBA
| 1 | Lea completamente las instrucciones de uso y el manual de funcionamiento de la prueba antes de la prueba y devuelva el reactivo a la habitación. temperatura antes de la prueba.No realice la prueba sin restaurar el reactivo a temperatura ambiente para evitar afectando la precisión de los resultados de la prueba. |
| 2 | Seleccione el modo de prueba estándar del analizador inmunológico portátil WIZ-A101 |
| 3 | Abra el paquete de bolsa de papel de aluminio de reactivo y saque el dispositivo de prueba; |
| 4 | Inserte horizontalmente el dispositivo de prueba en la ranura del analizador inmunológico; |
| 5 | En la página de inicio de la interfaz de operación del analizador inmunológico, haga clic en "Estándar" para ingresar a la interfaz de prueba; |
| 6 | Haga clic en "QC Scan" para escanear el código QR en el lado interior del kit;ingrese los parámetros relacionados con el kit en el instrumento y seleccione el tipo de muestra; Nota: Cada número de lote del kit se escaneará una vez.Si el número de lote ha sido escaneado, omita este paso; |
| 7 | Verifique la consistencia del "Nombre del producto", "Número de lote", etc. en la interfaz de prueba con la información en la etiqueta del kit; |
| 8 | Después de confirmar la consistencia de la información, comience a agregar la muestra: Paso 1: Extraiga lentamente 30 µL de muestra de suero/plasma a la vez.Tenga cuidado de no dibujar burbujas. Paso 2: agregue la muestra extraída a la solución A (tubo centrífugo transparente), extraiga y sople 3 o 4 veces (nota: el líquido de la tapa de la botella debe aspirarse en la botella); Paso 3: agregue toda la solución mezclada en la solución A (tubo de centrífuga transparente) en el tubo B (tubo de centrífuga rojo), revuelva uniformemente (nota: asegúrese de que el marcador esté sumergido en líquido) e incube a 37 ℃ durante 8 minutos; Paso 4: Pipetee 80 µL del líquido del paso 3 en el orificio de muestra del dispositivo de prueba.Evite dibujar burbujas durante el muestreo. |
| 9 | Después de completar la adición de la muestra, haga clic en "Tiempo" y el tiempo de prueba restante se mostrará automáticamente en la interfaz. |
| 10 | El analizador inmunológico completará automáticamente la prueba y el análisis cuando se alcance el tiempo de prueba. |
| 11 | Cálculo y visualización de resultados Una vez completada la prueba por el analizador inmunológico, el resultado de la prueba se mostrará en la interfaz de prueba o se puede ver a través de "Historial" en la página de inicio de la interfaz de operación. |
4. RENDIMIENTO CLÍNICO
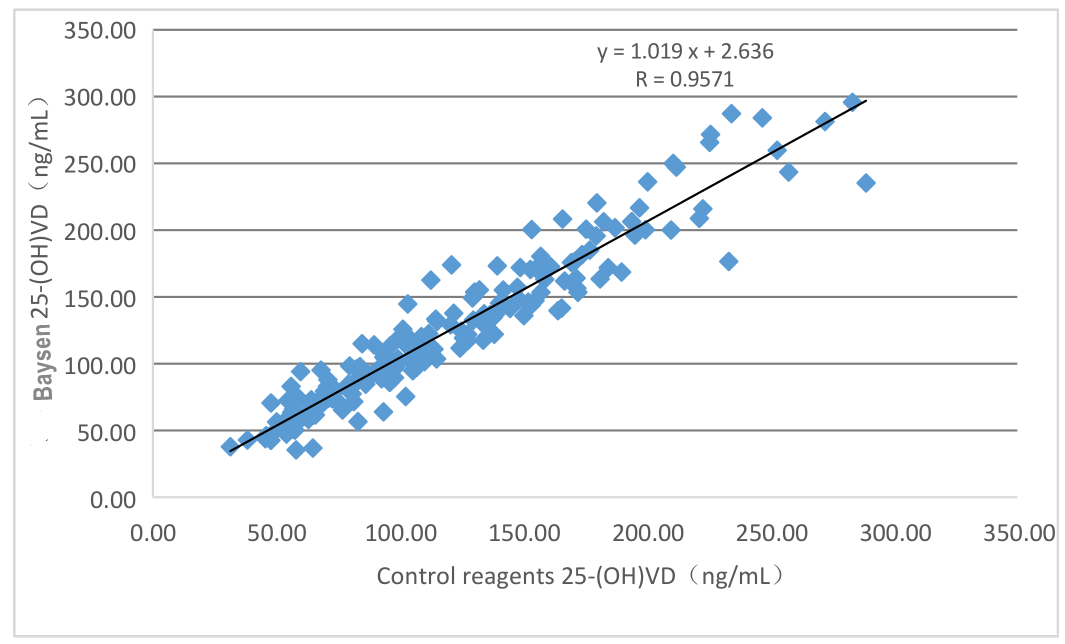
El rendimiento de la evaluación clínica del producto se evalúa mediante la recopilación de 196 muestras clínicas.Los resultados se comparan utilizando el correspondiente kit de quimioluminiscencia comercializado como reactivo de referencia.Utilice la regresión lineal para investigar su comparabilidad.Utilice la regresión lineal para investigar su comparabilidad.Los coeficientes de correlación de las dos pruebas son Y=1.019X-2.636 y R=0.9571, respectivamente.
5. CERTIFICADO
* Certificado del sistema ISO
* Certificado CE
* Registro UE
* Registro UCKA MHRA