Diagnosekit für glykosyliertes Hämoglobin A1c
1. VERWENDUNGSZWECK
Dieses Kit eignet sich für den quantitativen In-vitro-Nachweis des Gehalts an glykiertem Hämoglobin (HbA1c) in menschlichen Vollblutproben und wird hauptsächlich zur Durchführung der Zusatzdiagnose von Diabetes und zur Überwachung des Blutzuckerspiegels verwendet.Dieses Kit liefert nur das Testergebnis für glykosyliertes Hämoglobin.Das erhaltene Ergebnis sollte in Kombination mit anderen klinischen Informationen analysiert werden.Es darf nur von medizinischem Fachpersonal verwendet werden.
2. PRODUKTSPEZIFIKATION
| Modell Nr. | HbA1c |
| Methodik | Fluoreszenzimmunchromatographischer Assay |
| Beispielstyp | Vollblut |
| Zeit bis zum Ergebnis | 10-15 Min |
| Lagerung | 2~30 ℃/36~86℉ |
| Haltbarkeit | 24 Monate |
| Zertifikat | ISO13485, CE, MHRA |


| HAUPTKOMPONENTEN DES KITS *Testgerät *Probenverdünnungsmittel *Gebrauchsanweisung | Verpackung *25 Test/Kit *Beschriftung von Beuteln aus Aluminiumfolie *Schrumpffolie |
3. TESTMETHODE
| 1 | Lesen Sie vor dem Test die Gebrauchsanweisung und das Testhandbuch vollständig durch und bringen Sie das Reagenz vor dem Test wieder auf Raumtemperatur.Führen Sie den Test nicht durch, ohne das Reagenz wieder auf Raumtemperatur gebracht zu haben, um die Genauigkeit der Testergebnisse nicht zu beeinträchtigen. |
| 2 | Wählen Sie den Standardtestmodus des tragbaren Immunanalysators WIZ-A101 |
| 3 | Öffnen Sie den Aluminiumfolienbeutel mit den Reagenzien und nehmen Sie das Testgerät heraus. |
| 4 | Führen Sie das Testgerät horizontal in den Steckplatz des Immunanalysators ein. |
| 5 | Klicken Sie auf der Startseite der Bedienoberfläche des Immunanalysators auf „Standard“, um die Testoberfläche aufzurufen. |
| 6 | Klicken Sie auf „QC-Scan“, um den QR-Code auf der Innenseite des Kits zu scannen.Geben Sie kitbezogene Parameter in das Gerät ein und wählen Sie den Probentyp aus. Hinweis: Jede Chargennummer des Kits muss einmal gescannt werden.Wenn die Chargennummer gescannt wurde, überspringen Sie diesen Schritt. |
| 7 | Überprüfen Sie die Übereinstimmung von „Produktname“, „Chargennummer“ usw. auf der Testschnittstelle mit den Informationen auf dem Kit-Etikett. |
| 8 | Sobald die Informationen konsistent sind, nehmen Sie Probenpuffer, geben Sie 10 μl Vollblutprobe hinzu und mischen Sie 1 Minute lang ausreichend. |
| 9 | Geben Sie 80 µL der oben genannten Lösung mit gemischten Vertiefungen in das Probenloch des Testgeräts. |
| 10 | Nachdem die Probenzugabe abgeschlossen ist, klicken Sie auf „Timing“ und die verbleibende Testzeit wird automatisch auf der Benutzeroberfläche angezeigt. |
| 11 | Der Immunanalysator schließt den Test und die Analyse automatisch ab, wenn die Testzeit erreicht ist. |
| 12 | Ergebnisberechnung und -anzeige Nachdem der Test mit dem Immunanalysator abgeschlossen ist, wird das Testergebnis auf der Testoberfläche angezeigt oder kann über „Verlauf“ auf der Startseite der Bedienoberfläche eingesehen werden. |
4.KLINISCHE LEISTUNG
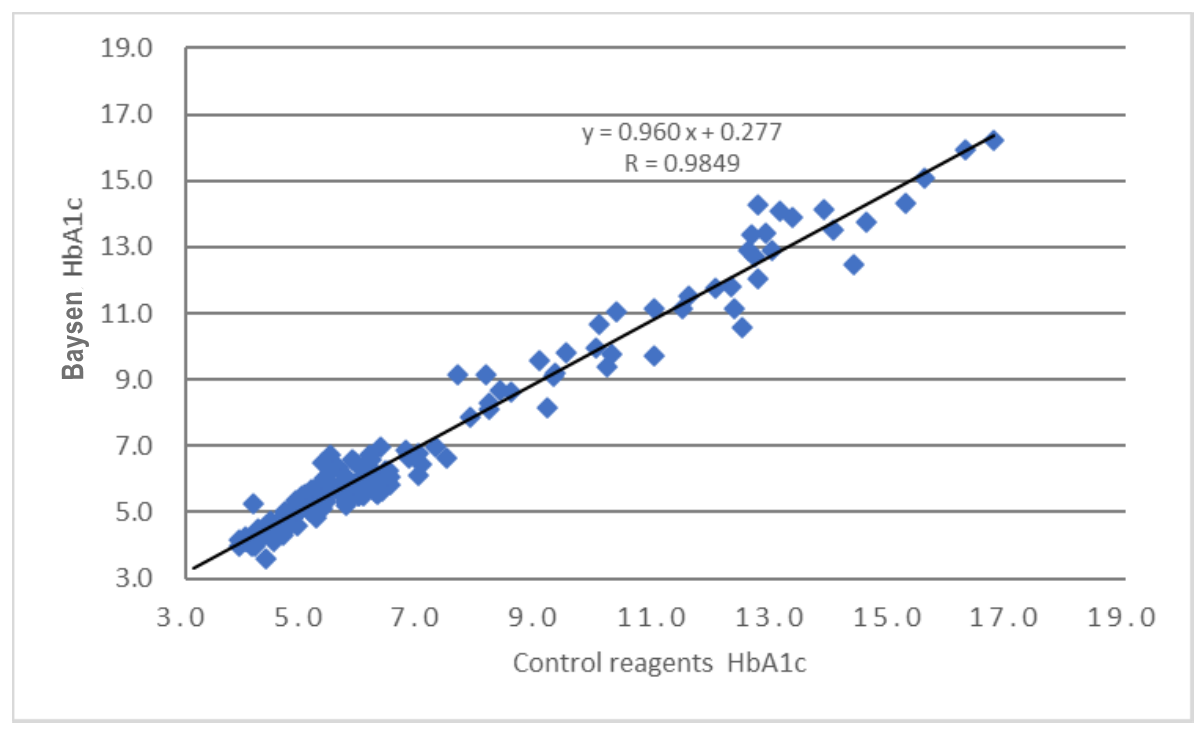
Die klinische Bewertungsleistung des Produkts wird durch die Sammlung von 155 klinischen Proben beurteilt.Als Referenzreagenz wird das entsprechende Kit der aufgeführten HPLC-Methode verwendet.Die Testergebnisse werden verglichen und ihre Vergleichbarkeit mit der Linearitätsregression untersucht.Die Korrelationskoeffizienten der beiden Tests betragen Y=0,960X+0,277 bzw. R=0,9849.
5. ZERTIFIKAT
* ISO-Systemzertifikat
* CE-Zertifikat
* EU-Registrierung
* UCKA MHRA-Registrierung